
|

|
Большая Советская Энциклопедия (цитаты)
|

|

|
 |
Электродный потенциал | Электродный потенциал (далее Э) разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электролита). Возникновение Э обусловливается переносом заряженных частиц через границу раздела фаз, специфической адсорбцией ионов, а при наличии полярных молекул (в том числе молекул растворителя) — ориентационной адсорбцией их. Величина Э в неравновесном состоянии зависит как от природы и состава контактирующих фаз, так и от кинетических закономерностей электродных реакций на границе раздела фаз. Равновесное значение скачка потенциалов на границе раздела электрод/раствор определяется исключительно особенностями электродной реакции и не зависит от природы электрода и адсорбции на нем поверхностно-активных веществ. Эту абсолютную разность потенциалов между точками, находящимися в двух разных фазах, нельзя измерить экспериментально или рассчитать теоретически. Практическое значение имеют относительные Э, обычно называемые просто Э, представляющие собой разность Э рассматриваемого электрода и электрода сравнения — чаще всего нормального водородного электрода, Э которого условно принимается равным нулю.
При электрохимическом равновесии на электроде величина Э (E) может быть выражена через изменение гиббсовой энергии (DG) реакции: Е = —DG/zF, где z — число электронов, участвующих в электрохимическом процессе, — Фарадея число. Э в этом случае зависит от активности (а) участвующих в реакции веществ (потенциалопределяющих веществ). Для электродов Me/Men+ Е = E0 + (RT/zF) ln aMen+, где R — газовая постоянная, Т — температура, E0 — нормальный потенциал. Для окислительно-восстановительных систем с инертным электродом, у которых все компоненты электрохимической реакции находятся в растворе, Э (окислительно-восстановительный потенциал) определяется активностями как окисленной (aok), так и восстановленной (ав) форм вещества:
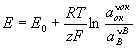 , ,
где n — стехиометрический коэффициент.
В случае, когда на электроде возможно одновременное протекание более одной электродной реакции, используется понятие стационарного Э При пропускании электрического тока измеренный Э будет отличаться от равновесного на величину поляризации (см. Поляризация электрохимическая).
Лит. см. при ст. Электрохимия.
В. В. Городецкий. |
Для поиска, наберите искомое слово (или его часть) в поле поиска
|

|
 |
 |
 |

|

|
Новости 30.01.2026 19:48:04
|

|

|
 |
|

|
 |
 |
 |
|