
|

|
Большая Советская Энциклопедия (цитаты)
|

|

|
 |
Олово | (далее О)(лат. Stannum), , элемент группы периодической системы номер 50, масса 118,69; белый блестящий металл, тяжелый, мягкий и пластичный. Элемент состоит из 10 изотопов с массовыми числами 112, 114—120, 122, 124; последний слабо радиоактивен; изотоп 120 наиболее распространен (около 33%).
Историческая справка. Сплавы О с — бронзы были известны уже в 4-м тыс. до н. э., а чистый металл во 2-м тыс. до н. э. В древнем мире из О делали украшения, посуду, утварь. Происхождение названий "stannum" и "олово" точно не установлено.
Распространение в природе. О — характерный элемент верхней части земной коры, его содержание в литосфере 2,5·10–4% по массе, в кислых изверженных породах 3·10–4%, а в более глубоких основных 1,5·10–4%; еще меньше О в мантии. Концентрирование О связано как с магматическими процессами (известны "оловоносные граниты", пегматиты, обогащенные О так и с гидротермальными процессами; из 24 известных минералов О 23 образовались при высоких температурах и давлениях. Главное промышленное значение имеет касситерит 2, меньшее — станнин 24 (см. Оловянные руды). В биосфере О мигрирует слабо, в морской воде его лишь 3·10–7%; известны водные растения с повышенным содержанием О Однако общая тенденция геохимии О в биосфере — рассеяние.
Физические и свойства. О имеет две полиморфные модификации. решетка обычного b- (белого О тетрагональная с периодами а = 5,813 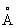 , с =3,176 , с =3,176 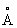 ; плотность 7,29 г/см3. При температурах ниже 13,2 °С устойчиво a- (серое О кубической структуры типа алмаза; плотность 5,85 г/см3. Переход b ® a сопровождается превращением металла в порошок (см. Оловянная чума), tпл 231,9 °С, tkип 2270 °С. Температурный коэффициент линейного расширения 23·10–6 (0—100 °С); удельная теплоемкость (0°С) 0,225 кдж/(кг·К), т. е. 0,0536 кал/(г·°С); теплопроводность (0 °С) 65,8 вт/(м·К), т. е. 0,157 кал/(см·-сек·°С); удельное электрическое сопротивление (20 °С) 0,115·10–6 ом·м, т. е. 11,5·10–6 ом ·см. Предел прочности при растяжении 16,6 Мн/м2 (1,7 кгс/мм2)", относительное удлинение 80—90%; твердость по Бринеллю 38,3—41,2 Мн/м2 (3,9—4,2 кгс/мм2). При изгибании прутков О слышен характерный хруст от взаимного трения ; плотность 7,29 г/см3. При температурах ниже 13,2 °С устойчиво a- (серое О кубической структуры типа алмаза; плотность 5,85 г/см3. Переход b ® a сопровождается превращением металла в порошок (см. Оловянная чума), tпл 231,9 °С, tkип 2270 °С. Температурный коэффициент линейного расширения 23·10–6 (0—100 °С); удельная теплоемкость (0°С) 0,225 кдж/(кг·К), т. е. 0,0536 кал/(г·°С); теплопроводность (0 °С) 65,8 вт/(м·К), т. е. 0,157 кал/(см·-сек·°С); удельное электрическое сопротивление (20 °С) 0,115·10–6 ом·м, т. е. 11,5·10–6 ом ·см. Предел прочности при растяжении 16,6 Мн/м2 (1,7 кгс/мм2)", относительное удлинение 80—90%; твердость по Бринеллю 38,3—41,2 Мн/м2 (3,9—4,2 кгс/мм2). При изгибании прутков О слышен характерный хруст от взаимного трения
В соответствии с конфигурацией внешних электронов 5s2 5p2 О имеет две степени окисления: +2 и +4; последняя более устойчива; соединения (П) — сильные восстановители. Сухим и влажным воздухом при температуре до 100 °С О практически не окисляется: его предохраняет тонкая, прочная и плотная пленка 2. По отношению к холодной и кипящей воде О устойчиво. Стандартный электродный потенциал О в кислой среде равен — 0,136 в. Из разбавленных и 24 на холоду О медленно вытесняет образуя соответственно 2 и сульфат 4. В горячей концентрированной 24 при нагревании О растворяется, образуя (4)2 и 2. Холодная (О °С) разбавленная кислота действует на О по реакции:
4 + 103 = 4 (3)2 + 43 + 32.
При нагревании с концентрированной 3 (плотность 1,2—1,42 г/см3) О окисляется с образованием осадка метаоловянной кислоты 23, степень гидратации которой переменна:
3+ 43 + n 2 = 323·n 2 + 4.
При нагревании О в концентрированных растворах щелочей выделяется и образуется гексагидростаннат:
+ 2КОН + 4Н2О = 2( () 6) + 22.
воздуха пассивирует О оставляя на его поверхности пленку 2. двуокись 2 очень устойчива, а окись быстро окисляется, ее получают косвенным путем. 2 проявляет преимущественно кислотные свойства, — основные.
С О непосредственно не соединяется; гидрид 4 образуется при взаимодействии 2 и соляной кислоты:
2 + 4 = 22 + 4.
Это бесцветный ядовитый газ, tkип —52 °С; он очень непрочен, при комнатной температуре разлагается на и 2 в течение нескольких суток, а выше 150 °С — мгновенно. Образуется также при действии в момент выделения на соли О например:
2 + 4 + 3 = 32 + 4.
С галогенами О дает соединения состава SnX2 и SnX4. Первые солеобразны и в растворах дают ионы 2+, вторые (кроме 4) гидролизуются водой, но растворимы в неполярных органических жидкостях. Взаимодействием О с сухим ( + 22 = 4) получают тетрахлорид 4; это бесцветная жидкость, хорошо растворяющая серу, Раньше по приведенной реакции удаляли О с вышедших из строя луженых изделий. Сейчас способ мало распространен из-за токсичности и высоких потерь О
Тетрагалогениды SnX4 образуют комплексные соединения с 2, 3, окислами 5, спиртами, эфирами и многими органическими соединениями. С галогеноводородными кислотами галогениды О дают комплексные кислоты, устойчивые в растворах, например 24 и 26. При разбавлении водой или нейтрализации растворы простых или комплексных гидролизуются, давая белые осадки () 2 или 23·n 2. С серой О дает нерастворимые в воде и разбавленных кислотах сульфиды: коричневый и 2.
Получение и применение. Промышленное получение О целесообразно, если содержание его в россыпях 0,01%, в рудах 0,1%; обычно же десятые и единицы процентов. О в рудах часто сопутствуют , , , , редкоземельные элементы, Та, и др. ценные металлы. Первичное сырье обогащают: россыпи — преимущественно гравитацией, руды — также флотогравитацией или флотацией.
Концентраты, содержащие 50—70% О обжигают для удаления серы, очищают от действием . Если же присутствуют примеси (, ) 4 и шеелита 4, концентрат обрабатывают ; образовавшуюся 3·2 извлекают с помощью 4. Плавкой концентратов с углем в электрических или пламенных печах получают черновое О (94—98% ), содержащее примеси , , , , , . При выпуске из печей черновое О фильтруют при температуре 500—600 °С через кокс или центрифугируют, отделяя этим основную массу Остаток и удаляют вмешиванием в жидкий металл элементарной серы; примеси всплывают в виде твердых сульфидов, которые снимают с поверхности О От и О рафинируют аналогично — вмешиванием от — с помощью 2. Иногда и испаряют в вакууме. Электролитическое рафинирование и зонную перекристаллизацию применяют сравнительно редко для получения особо чистого О
Около 50% всего производимого О составляет вторичный металл; его получают из отходов белой жести, лома и различных сплавов. До 40% О идет на лужение консервной жести, остальное расходуется на производство припоев, подшипниковых и типографских сплавов (см. Оловянные сплавы). Двуокись 2 применяется для изготовления жаростойких эмалей и глазурей. Соль — станнит 23·32 используется в протравном крашении тканей. 2 ("сусальное входит в состав красок, имитирующих позолоту. Станнид 3 — один из наиболее используемых сверхпроводящих материалов.
Н. Н. Севрюков.
Токсичность самого О и большинства его неорганических соединений невелика. Острых отравлений, вызываемых широко используемым в промышленности элементарным О практически не встречается. Отдельные случаи отравлений, описанные в литературе, по-видимому, вызваны выделением 3 при случайном попадании воды на отходы очистки О от У рабочих заводов при длительном воздействии пыли окиси О (т. н. черное О ) могут развиться пневмокониозы, у рабочих, занятых изготовлением фольги, иногда отмечаются случаи хронической экземы. Тетрахлорид О (4·52) при концентрации его в воздухе свыше 90 мг/м3 раздражающе действует на верхние дыхательные пути, вызывая кашель; попадая на кожу, О вызывает ее изъязвления. Сильный судорожный яд — (станнометан, 4), но вероятность образования его в производственных условиях ничтожна. Тяжелые отравления при употреблении в пищу давно изготовленных консервов могут быть связаны с образованием в консервных банках 4 (за счет действия на полуду банок органических кислот содержимого). Для острых отравлений характерны судороги, нарушение равновесия; возможен смертельный исход.
Органические соединения О особенно ди- и триалкильные, обладают выраженным действием на центральную нервную систему. Признаки отравления триалкильными соединениями: головная боль, рвота, головокружение, судороги, парезы, параличи, зрительные расстройства. Нередко развиваются коматозное состояние (см. Кома), нарушения сердечной деятельности и дыхания со смертельным исходом. Токсичность диалкильных соединений О несколько ниже, в клинической картине отравлений преобладают симптомы поражения печени и желчевыводящих путей. Профилактика: соблюдение правил гигиены труда.
О как художественный материал. Отличные литейные свойства, ковкость, податливость резцу, благородный цвет обусловили применение О в декоративно-прикладном искусстве. В Древнем Египте из О выполнялись украшения, напаянные на другие металлы. С конца 13 в. в западно-европейских странах появились сосуды и церковная утварь из О близкие но более мягкие по абрису, с глубоким и округлым штрихом гравировки (надписи, орнаменты). В 16 в. Ф. Брио ( и К. Эндерлайн ( начали отливать парадные чаши, блюда, кубки из О с рельефными изображениями (гербы, мифологические, жанровые сцены). А. Ш. Буль вводил О в маркетри при отделке мебели. В России изделия из О (рамы зеркал, утварь) получили широкое распространение в 17 в.; в 18 в. на севере России расцвета достигло производство подносов, чайников, табакерок, отделанных накладками с эмалями. К началу 19 в. сосуды из О уступили место фаянсовым и обращение к О как художественному материалу стало редким. Эстетические достоинства современных декоративных изделий из О — в четком выявлении структуры предмета и зеркальной чистоте поверхности, достигаемой литьем без последующей обработки.
Лит.: Севрюков Н. Н., в кн.: Краткая энциклопедия, т. 3, М., 1963, с. 738—39; Металлургия М., 1964; Некрасов Б. В., Основы общей химии, 3 изд., т. 1, М., 1973, с. 620—43; Рипан ., Четяну И., Неорганическая ч. 1 — металлов, пер. с рум., М., 1971, с. 395—426; Профессиональные болезни, 3 изд., М., 1973; Вредные вещества в промышленности, ч. 2, 6 изд., М,, 1971; Tardy, Les étains français, pt. 1—4, ., 1957—64; Mory L., Schönes Zinn, Münch., 1961; Haedeke ., Zinn, Braunschweig, 1963.
|
Для поиска, наберите искомое слово (или его часть) в поле поиска
|

|
 |
 |
 |
|