
|

|
Большая Советская Энциклопедия (цитаты)
|

|

|
 |
Михаэлиса константа | Михаэлиса константа (далее М) один из важнейших параметров кинетики ферментативных реакций, введенный немецкими учеными Л. Михаэлисом (L. Michaelis) и М. Ментен в 1913; характеризует зависимость скорости ферментативного процесса от концентрации субстрата. Согласно теории Михаэлиса — Ментен, первым этапом любого ферментативного процесса является обратимая реакция между ферментом (Е) и субстратом (), приводящая к образованию промежуточного фермент-субстратного комплекса (ES), который затем подвергается практически необратимому расщеплению на продукт реакции (Р) и исходный фермент:
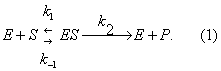
Реакции образования и распада комплекса ES характеризуются константами скорости k1, k-1, k2. Если концентрация субстрата значительно превышает концентрацию фермента (() >> (E)) и, следовательно, концентрация ES становится постоянной, скорость ферментативной реакции (u) выражается уравнением:
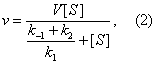
где — максимальная скорость реакции, достигаемая при полном насыщении фермента субстратом. Соотношение констант скорости
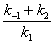
также является константой (Кm), получившей название М Подставляя в уравнение (2) М, получаем уравнение Михаэлиса — Ментен:
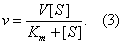
Из уравнения (3) следует, что М численно равна концентрации субстрата, при которой скорость реакции составляет половину максимально возможной (см. рис.). В ряде случаев, когда величина k1 мала и ею можно пренебречь, М становится равной
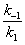
и может служить мерой сродства субстрата к ферменту. М имеет размерность концентрации. Практически величину М находят различными графическими методами, исследуя зависимость скорости ферментативной реакции от концентрации субстрата. См. также Ферментативный катализ.
Лит.: Яковлев В. А., Кинетика ферментативного катализа, М., 1965; Уэбб Л., Ингибиторы ферментов и метаболизма, пер. с англ., М., 1966. Д.
Д. М. Беленький.
|
Для поиска, наберите искомое слово (или его часть) в поле поиска
|

|
 |
 |
 |
|