
|

|
Большая Советская Энциклопедия (цитаты)
|

|

|
 |
Актиноиды | Актиноиды (далее А) семейство из 14 элементов с номерами Z 90 — 103, расположенных в 7 периоде системы за актинием и относящихся, как и к группе системы. К А принадлежат: торий (Z=90), протактиний (91), уран (92), нептуний (93), плутоний (94), америций (95), кюрий (96), берклий (97), калифорний (98), (99), фермий (100), менделевий (101), элемент № 102, не имеющий пока общепринятого названия, и лоуренсий (103). Все А радиоактивны, т. е. не имеют стабильных изотопов. , и принадлежат к естественно-радиоактивным элементам, встречающимся в природе, и открытым ранее др. А Остальные А, часто называемые трансурановыми элементами, получены в 1940—63 искусственным путем при помощи ядерных реакций. Из них только и обнаружены в ничтожно малых количествах в некоторых радиоактивных рудах, более "тяжелые" А (т. е. А с большими номерами) в природе не найдены. Огромная заслуга в изучении А принадлежит американскому химику Г. Т. Сиборгу, который выдвинул гипотезу о существовании группы А (1942) и под руководством или при участии которого было впервые синтезировано девять А Выделение А в специальное семейство связано со схожестью свойств этих элементов между собой и с что объясняется сходным строением наружных электронных оболочек их (см. ниже).
Название А (от актиний и греч. éidos — вид) означает — подобные Оно дано А по аналогии с лантаноидами — семейством из 14 элементов, также относящихся к группе системы и следующих в 6-м периоде за Свойства элементов обоих семейств во многом сходны друг с другом.
Близость свойств А между собой и их сходство с связаны с особенностями строения электронных оболочек этих семейств. Как известно, состоит из ядра и электронных оболочек, число которых равно номеру периода элемента в таблице (у А электронных оболочек 7). Отличие А (и соответственно от др. элементов состоит в том, что при переходе от первого А — (Z = 90) ко второму — (Z = 91) и т. д. вплоть до последнего А — (Z = 103), каждый новый электрон, появляющийся в параллельно с увеличением номера (Z), попадает не на внешние оболочки (6-ю и 7-ю от ядра), как это бывает обычно, а заполняет более близкую к ядру 5-ю оболочку. У (число оболочек 6) также заполняется электронами более близкая к ядру 4-я оболочка (а не наружные — 5-я и 6-я). Таким образом, у элементов обоих семейств происходит заполнение 3-й снаружи электронной оболочки, а строение 2 наружных оболочек оказывается сходным. Число электронов на этих наружных оболочках у А и как правило, не отличается более чем на 1, причем почти во всех случаях представители каждого из семейств, равноудаленные соответственно от и содержат на 2 наружных оболочках строго одинаковое число электронов. (Здесь изложен лишь принцип заполнения электронных оболочек у обоих семейств; во многих случаях, особенно у А, порядок заполнения сложнее. См. Атом и Периодическая система элементов Д. И. Менделеева). Электронные конфигурации А даны в таблице.

То обстоятельство, что при переходе от к число электронов на 2 внешних оболочках, как правило, не изменяется, а положительный заряд ядра постепенно возрастает, вызывает более сильное притяжение внешних электронов к ядру и приводит к т. н. актиноидному сжатию: у нейтральных и ионов А одинаковой валентности при увеличении номера радиусы не увеличиваются, как это обычно бывает, а даже несколько уменьшаются (например, радиус 3+ равен 1,03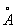 , 3+ — 1,01 , 3+ — 1,01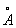 , 3+ — 1,00 , 3+ — 1,00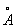 , 3+ — 0,99 , 3+ — 0,99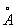 и т. д.). и т. д.).
свойства элемента зависят в основном от числа электронов на наружных слоях и размера и ионных радиусов, поэтому не удивительно, что во-первых, свойства А близки между собой, и, во-вторых, поведение А и обладает большим сходством. Это сходство особенно заметно тогда, когда элементы находятся в одинаковом валентном состоянии. Так, 3-валентные А образуют те же нерастворимые соединения (гидроокиси, карбонаты, оксалаты и др.), что и 3-валентные трифториды, трихлориды и другие аналогичные соединения 3-валентных А образуют изоструктурные ряды (другими словами, соединения, входящие в такие ряды, например в ряд MeCl3, где Me — А, обладают сходными решетками, параметры которых постепенно уменьшаются по мере роста номера (Z) А). Такие же изоструктурные ряды образуют двуокиси, тетрафториды, гексафториды и другие соединения А По склонности к гидролизу соединения 5-валентных А, например пентахлориды, очень близки между собой. В растворах 6-валентные А существуют в виде МеО22+-ионов и т. д. Приведенные примеры далеко не исчерпывают всех случаев сходства А, пои на них можно убедиться в его наличии.
Однако, кроме общих черт, между А и имеется и существенная разница. Так, А часто образуют соединения в состояниях окисления, значительно более высоких, чем +3, что не характерно для В своих соединениях А проявляют следующие валентности (наиболее типичная выделена жирным шрифтом): (3, 4), (3, 4,5), (3, 4, 5, 6), (3, 4, 5, 6, 7), (3,4,5, 6, 7), (3, 4, 5, 6), (3, 4), (3,4), (2, 3), (3), (3), (2, 3), № 102 (2, 3). Таким образом, валентность 3 характерна для А только после . Первые члены семейства А (, и ) в своих соединениях чаще бывают соответственно 4-, 5- и 6-валентными. А в большей степени, чем склонны к комплексообразованию. Указанные особенности А объясняются тем, что "вновь пришедшие" на 5-ю от ядра оболочку электроны (т. н. 5f-электроны или электроны 5f-подуровня) по энергии связи с ядром очень близки к электронам 6-й оболочки (т. н. 6d-электронам или электронам 6d-подуровня); эти 6d-электроны и могут проявлять себя как дополнительные валентные (см. табл.). У же "вновь пришедшие" 4f-электроны всегда связаны с ядром значительно прочнее, чем 5d-электроны. Близость энергии связи с ядром 5f- и 6d-электронов у , и приводит к тому, что f-электроны 5-й оболочки также могут проявлять себя как валентные. Валентность 3 оказывается для этих элементов не характерной, и по многим своим признакам они похожи на элементы не , а, соответственно, , и групп периодической системы (и долгое время в эти группы и помещались). В 1930-х и в начале 1940-х гг. считалось, что и следующие за элементы и также должны относиться соответственно к и группам периодической системы, или, вследствие обнаруженных у и черт сходства с , их следует разместить вместе с в группе. Однако анализ закономерностей изменения свойств элементов 7-го периода, особенно после открытия следующих за А, а также найденное экспериментально сходство спектроскопических и характеристик соединений элементов, следующих за с соответствующими характеристиками навели Сиборга на мысль, что трансурановые элементы должны рассматриваться как аналоги в результате чего и была выдвинута гипотеза о существовании семейства А Актиноидная гипотеза в значительной мере способствовала успехам открытия , и последующих А, т. к. из нее следовало, что наиболее характерная валентность этих элементов должна быть равна 3, а не 4 и 6, как первоначально предполагали, и, следовательно, в этом валентном состоянии их и надо искать.
Электронные конфигурации актиноидов<
| Элемент< |
Число электронов на некоторых подуровнях
|
5-й оболочки
|
6-й оболочки
|
7-й оболочки
|
s
|
p
|
d
|
f
|
s
|
p
|
d
|
s
| | |
2
|
6
|
10
|
0
|
2
|
6
|
2
|
2
|
|
2
|
6
|
10
|
2
|
2
|
6
|
1
|
2
|
|
2
|
6
|
10
|
3
|
2
|
6
|
1
|
2
|
|
2
|
6
|
10
|
4
|
2
|
6
|
1
|
2
|
|
2
|
6
|
10
|
6
|
2
|
6
|
0
|
2
|
|
2
|
6
|
10
|
7
|
2
|
6
|
0
|
2
|
|
2
|
6
|
10
|
7
|
2
|
6
|
1
|
2
|
|
2
|
6
|
10
|
8
|
2
|
6
|
1
|
2
|
|
2
|
6
|
10
|
9
|
2
|
6
|
1
|
2
|
|
2
|
6
|
10
|
11
|
2
|
6
|
0
|
2
|
|
2
|
6
|
10
|
12
|
2
|
6
|
0
|
2
|
|
2
|
6
|
10
|
13
|
2
|
6
|
0
|
2
|
102
|
2
|
6
|
10
|
14
|
2
|
6
|
0
|
2
|
|
2
|
6
|
10
|
14
|
2
|
6
|
1
|
2
|
Свойства элементов, отнесенных Сиборгом к числу А, по рассмотренным выше причинам, значительно сильнее различаются между собой, чем свойства и поэтому вопрос о том, существует ли в действительности в 7-м периоде семейство А (аналогичное семейству 6-го периода), или строение 7-го периода в этой его части более сложное, долгое время не был решен до конца. Решающее значение для окончательного вывода о строении 7-го периода имело изучение свойств 104-го элемента — курчатовия (открытого Г. Н. Флеровым с сотрудниками в 1964), проведенное в 1966 под руководством чешского химика И. Звары в Дубне (СССР). Оказалось, что по своим свойствам курчатовий резко отличается от предшествующих элементов и представляет собой аналог принадлежащего уже к группе периодической системы. Теоретические же расчеты показывают, что число элементов, у которых заполняется f-подуровень 3-й снаружи электронной оболочки, должно быть равно 14, и поэтому следует принять, что семейство 14 А начинается с и завершается у . В настоящее время все А, как и принято размещать в отдельном ряду внизу периодической системы.
Из-за близости свойств А, особенно трансурановых, отделить их друг от друга крайне сложно. Для разделения А очень полезным оказался метод ионообменной хроматографии, которым широко пользуются и для разделения Поскольку этот метод сыграл важную роль в открытии и изучении А и, кроме того, дает ясное представление о работе с этими элементами, с ним стоит познакомиться подробнее. Стеклянную трубку, расположенную вертикально, заполняют специальным органическим полимером или смолой, а затем на этот полимер подают раствор, содержащий, например, 3-валентные ионы А Ионы реагируют с полимером и оказываются связанными с ним Для извлечения А из трубки колонки через нее пропускают раствор, который содержит вещества, способные образовывать с ионами А более прочные связи, чем органический полимер. Порядок выхода А из колонки зависит, в основном, от ионного радиуса элементов, причем можно подобрать такие условия, что быстрее всего колонку покинут ионы с наименьшими радиусами. Т. к. радиусы ионов от к постепенно уменьшаются, то выход ионов А будет происходить в последовательности, обратной их номерам Z. Порядок в выходе А выполняется столь строго, что дает возможность по наличию радиоактивных в той или иной порции раствора, прошедшего через колонку, сделать вывод, какие именно элементы присутствуют в смеси, и точно определить их порядковые номера. Метод обладает высокой избирательностью, требует небольших затрат времени и пригоден даже тогда, когда в наличии имеется лишь несколько элемента. Он был использован, в частности, при открытии , , , и .
Из всех А к настоящему времени практическое. применение находят главным образом , и Р . Изотопы 233, 235 и 239 служат как ядерное горючее в реакторах и играют роль взрывчатого вещества в бомбах. Некоторые изотопы А (238, 242 и др.), испускающие a-частицы высокой энергии, могут служить для создания источников тока со сроком службы до 10 лет и более, необходимых, например, для питания навигационной радиоаппаратуры спутников. В таких источниках тока тепловая энергия, выделяющаяся при радиоактивном распаде, при помощи специальных устройств преобразуется в электрический ток. Изучение свойств А имеет большое теоретическое значение, т. к. позволяет расширить знания о свойствах ядер, поведении элементов и т. д.
Лит.: Хайд И., Сиборг Г. Т., Трансурановые элементы, пер. с англ., М., 1959; Сиборг Г., Кац Дж., элементов, пер. с англ., М., 1960; Гольданский В. И., Новые элементы в Периодической системе Д. И. 3 изд., М., 1964; Лапицкий А В., Цисурановые и трансурановые элементы, в сборнике: Рассказывают ученые-химики, М., 1964; Сиборг Г., Искусственные трансурановые элементы, пер. с англ., М., 1965; Хайд Э., Перлман И., Сиборг Г., Ядерные свойства тяжелых элементов, в. 1, Трансурановые элементы, пер. с англ., М., 1967.
С. С. Бердоносов. |
Для поиска, наберите искомое слово (или его часть) в поле поиска
|

|
 |
 |
 |
|