
|

|
Большая Советская Энциклопедия (цитаты)
|

|

|
 |
Фотохимия | Фотохимия (далее Ф) раздел химии, в котором изучаются реакции химические, происходящие под действием света. Ф тесно связана с оптикой и оптическими излучениями. Первые фотохимические закономерности были установлены в 19 в. (см. Гротгуса закон, Бунзена – Роско закон). Как самостоятельная область науки Ф оформилась в 1-й трети 20 в., после открытия Эйнштейна закона, ставшего основным в Ф Молекула вещества при поглощении кванта света переходит из основного в возбужденное состояние, в котором она и вступает в реакцию. Продукты этой первичной реакции (собственно фотохимической) часто участвуют в различных вторичных реакциях (т. н. темновые реакции), приводящих к образованию конечных продуктов. С этой точки зрения Ф можно определить как химию возбужденных молекул, образовавшихся при поглощении квантов света. Часто более или менее значительная часть возбужденных молекул не вступает в фотохимическую реакцию, а возвращается в основное состояние в результате различного рода фотофизических процессов дезактивации. В ряде случаев эти процессы могут сопровождаться испусканием кванта света (флуоресценция или Отношение числа молекул, вступивших в фотохимическую реакцию, к числу поглощенных квантов света называются квантовым выходом фотохимической реакции. Квантовый выход первичной реакции не может быть больше единицы; обычно эта величина значительно меньше единицы из-за эффективной дезактивации. Вследствие же темновых реакций общий квантовый выход может быть значительно больше единицы.
Наиболее типичная фотохимическая реакция в газовой фазе – диссоциация молекул с образованием и радикалов. Так, при действии коротковолнового ультрафиолетового (УФ) излучения, которому подвергается, например, образующиеся возбужденные молекулы 2* диссоциируют на
2 + hn  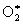 , , 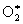 ® + . ® + .
Эти вступают во вторичную реакцию с 2, образуя озон: + 2 ® 3.
Такие процессы происходят, например, в верхних слоях атмосферы под действием излучения Солнца (см. Озон в атмосфере).
При освещении смеси с насыщенными углеводородами (RH, где R – алкил) происходит последних. Первичная реакция – диссоциация молекулы на за ней следует цепная реакция образования углеводородов:
2 + hn ® 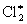 ® + ® +
+ RH ® + R
R + 2 ® RCl + и т.д.
Общий квантовый выход этой цепной реакции значительно больше единицы.
При освещении лампой смеси паров с свет поглощается только Последние, переходя в возбужденное состояние, вызывают диссоциацию молекул
* + 2 ® + + .
Это пример сенсибилизированной фотохимической реакции. Под действием кванта света, обладающего достаточно высокой энергией, молекулы превращаются в ионы. Этот процесс, называемый фотоионизацией, удобно наблюдать с помощью масс-спектрометра.
Простейший фотохимический процесс в жидкой фазе – перенос электрона, т. е. вызванная светом окислительно-восстановительная реакция. Например, при действии УФ света на водный раствор, содержащий ионы 2 +, 2 +, 2 + и др., электрон переходит от возбужденного иона к молекуле воды, например:
(2 +*( + 2 ® 3 + + - + Н +.
Вторичные реакции приводят к образованию молекулы Перенос электрона, который может происходить при поглощении видимого света, характерен для многих красителей. Фотоперенос электрона с участием молекулы представляет собой первичный акт фотосинтеза – сложного фотобиологического процесса, происходящего в зеленом листе под действием солнечного света.
В жидкой фазе молекулы органических соединений с кратными связями и ароматическими кольцами могут участвовать в разнообразных темновых реакциях. Кроме разрыва связей, приводящего к образованию радикалов и бирадикалов (например, карбенов), а также гетеролитических реакций замещения, известны многочисленные фотохимические процессы изомеризации, перегруппировок, образования циклов и др. Существуют органические соединения, которые под действием УФ света изомеризуются и приобретают окраску, а при освещении видимым светом снова превращаются в исходные бесцветные соединения. Это явление, получившее название фотохромии, – частный случай обратимых фотохимических превращений.
Задача изучения механизма фотохимических реакций весьма сложна. Поглощение кванта света и образование возбужденной молекулы происходят за время порядка 10-15сек. Для органических молекул с кратными связями и ароматическими кольцами, представляющих для Ф наибольший интерес, существуют два типа возбужденных состояний, которые различаются величиной суммарного спина молекулы. Последний может быть равен нулю (в основном состоянии) или единице. Эти состояния называются соответственно синглетными и триплетными. В синглетное возбужденное состояние молекула переходит непосредственно при поглощении кванта света. Переход из синглетного в триплетное состояние происходит в результате фотофизического процесса. Время жизни молекулы в возбужденном синглетном состоянии составляет ~ 10-8 сек; в триплетном состоянии – от 10-5–10-4 сек (жидкие среды) до 20 сек (жесткие среды, например твердые полимеры). Поэтому многие органические молекулы вступают в реакции именно в триплетном состоянии. По этой же причине концентрация молекул в этом состоянии может стать столь значительной, что молекулы начинают поглощать свет, переходя в высоковозбужденное состояние, в котором они вступают в т. н. двухквантовые реакции. Возбужденная молекула А* часто образует комплекс с невозбужденной молекулой А или с молекулой В. Такие комплексы, существующие только в возбужденном состоянии, называются соответственно эксимерами (AA*( или эксиплексами (AB*(. Эксиплексы часто являются предшественниками первичной реакции. Первичные продукты фотохимической реакции – радикалы, ионы, ион-радикалы и электроны – быстро вступают в дальнейшие темновые реакции за время, не превышающее обычно 10-3 сек.
Один из наиболее эффективных методов исследования механизма фотохимических реакций – импульсный фотолиз, сущность которого заключается в создании высокой концентрации возбужденных молекул путем освещения реакционной смеси кратковременной, но мощной вспышкой света. Возникающие при этом короткоживущие частицы (точнее – возбужденные состояния и названные выше первичные продукты фотохимической реакции) обнаруживаются по поглощению ими "зондирующего" луча. Это поглощение и его изменение во времени регистрируется при помощи фотоумножителя и осциллографа. Таким методом можно определить как спектр поглощения промежуточной частицы (и тем самым идентифицировать эту частицу), так и кинетику ее образования и исчезновения. При этом применяются лазерные импульсы продолжительностью 10-8 сек и даже 10-11–10-12сек, что позволяет исследовать самые ранние стадии фотохимического процесса.
Область практического приложения Ф обширна. Разрабатываются способы синтеза на основе фотохимических реакций (см. Фотохимический реактор, Солнечная фотосинтетическая установка). Нашли применение, в частности для записи информации, фотохромные соединения. С применением фотохимических процессов получают рельефные изображения для микроэлектроники, печатные формы для полиграфии (см. также Фотолитография). Практическое значение имеет фотохимическое (главным образом насыщенных углеводородов). Важнейшая область практического применения Ф – фотография. Помимо фотографического процесса, основанного на фотохимическом разложении галогенидов (главным образом ), все большее значение приобретают различные методы несеребряной фотографии; например, фотохимическое разложение диазосоединений лежит в основе диазотипии.
Лит.: Турро Н. Д., Молекулярная фотохимия, пер. с англ., М., 1967; Теренин А. Н., Фотоника молекул красителей и родственных органических соединений, Л., 1967; Калверт Д. Д., Питтс Д. Н., Ф, пер. с англ., М., 1968; Багдасарьян Х. С., Двухквантовая фотохимия, М., 1976.
Х. С. Багдасарьян.
|
Для поиска, наберите искомое слово (или его часть) в поле поиска
|

|
 |
 |
 |

|

|
Новости 30.01.2026 03:09:32
|

|

|
 |
|

|
 |
 |
 |
|