
|

|
Большая Советская Энциклопедия (цитаты)
|

|

|
 |
Фосфаты | Фосфаты (далее Ф) соли и эфиры кислот. Из солей различают ортофосфаты и полимерные (или конденсированные) Ф Последние делят на полифосфаты, имеющие линейное строение фосфат-анионов, метафосфаты с кольцеобразным (циклическим) фосфат-анионом и ультрафосфаты с сетчатой, разветвленной структурой фосфат-аниона. К Ф относят также весьма стойкие соединения – фосфаты бора 4 и 4 (хотя правильнее было бы считать их смешанными ангидридами 25 и 23; 25 и 23).
Ортофосфаты – соли ортофосфорной кислоты 34 – известны одно-, двух- и трехзамещенные. Однозамещенные ортофосфаты, содержащие анион 24, растворимы в воде, из двух- и трехзамещенных ортофосфатов, содержащих соответственно анионы 42- и 43-, растворимы только соли щелочных металлов и аммония. Трехзамещенные ортофосфаты, за исключением триаммоний фосфата (4)34×32, термически устойчивы; трикальцийфосфат заметно диссоциирует лишь при температурах выше 2000 °С (диссоциация улучшается под вакуумом): 3(4)2 = 3 + 25. При нагревании одно- и двухзамещенных ортофосфатов происходит их дегидратация с выделением структурной воды и образованием полимерных (линейных или кольцевых) фосфатов по схеме:
(n-2) MeH24 (2Me24 (Men + 2n3n + 1 + (n-1) 2
(где n – степень полимеризации).
Все встречающиеся в природе соединения представляют собой ортофосфаты (см. Ф природные). В промышленности растворимые в воде ортофосфаты получают по следующей схеме: 1) производство из природных Ф (главным образом апатитов) ортофосфорной кислоты (см. Фосфорные кислоты); 2) взаимодействие ортофосфорной кислоты с гидроокисями, аммиаком, или карбонатами, например:
34 + MH3 = 424
34 + = 24 –
Труднорастворимые ортофосфаты тяжелых металлов (например, , ) образуются в результате обменных реакций, например:
224 + 33 = 34 + 33 + 24
Полимерные Ф различных структурных типов могут быть описаны формулами: линейные полифосфаты Men + 2n3n + 1, или
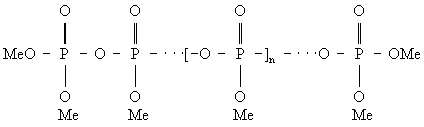
кольцевые метафосфаты Menn3n, или
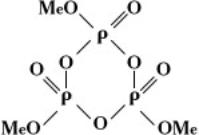
(где n – степень полимеризации).
Свойства полимерных Ф зависят от характера катиона, строения фосфат-аниона, степени полимеризации, структуры фосфата и др. Так, например, растворимость линейных полифосфатов, как правило, падает с увеличением степени полимеризации, но может быть увеличена путем модифицирования полифосфатов, например изменением скорости охлаждения расплава.
Получают полимерные Ф (линейные и кольцевые) в основном термической дегидратацией одно- и двухзамещенных ортофосфатов или нейтрализацией соответствующих поли- или мета- (циклических) кислот:
n + 2n3n + 1 + nN3 = (4) n 2n3n + 1
(иногда эти процессы совмещаются, как, например, при высокотемпературной аммонизации ортофосфорной кислоты для получения полифосфатов аммония). В промышленных масштабах эти способы используют для получения пиро-, триполифосфатов (соответственно 427, 5310) и в меньшей степени – а также полимерных метафосфатов ( стекла, метафосфат и др.).
Из циклических метафосфатов наиболее изучены тримета-, тетрамета-, гексамета- и октаметафосфаты.
Ультрафосфаты – соединения общей формулы MenRnn (5 + R)/2, где R = Me2/25, как правило, аморфные, стеклообразные вещества, гигроскопичные, легко гидролизующиеся на воздухе с образованием поли- и метафосфатов. Последние в присутствии большого количества воды могут гидролизоваться за счет полного расщепления Р–О–Р-связей вплоть до ортофосфатов. Выделенные в виде ультрафосфаты и некоторых как правило, не гигроскопичны. Ультрафосфаты образуются в результате термической дегидратации смеси ортофосфатов с кислотами или с ангидридом, т. е. при наличии условия
О < Me2/25 < 1.
Ф аммония, и др. широко применяются в качестве фосфорных удобрений. В 70-е гг. 20 в. выросло производство кормовых фосфатов (например, обесфторенные Ф, преципитат, динатрийфосфат, фосфаты мочевины – 34×(2)2 и др.). Ф и (особенно триполифосфаты) применяют в качестве компонентов жидких и порошкообразных моющих средств и поверхностно-активных веществ при буровых работах, в цементной, текстильной промышленности при подготовке шерсти, хлопка к белению и крашению. Ф используют в пищевой промышленности в качестве рыхлителей теста, например (4)24. Некотоpые Ф (например, 4) применяют в качестве катализаторов в реакциях органического синтеза. Ф преимущественно щелочных металлов входят в состав эмалей, глазурей, стекол, огнестойких материалов (как антипирены), а также мягких абразивов; они используются при фосфатировании металлов (, , ). однозамещенных фосфатов аммония применяются как сегнетоэлектрики и пьезоэлектрические материалы. Ф используются в фармацевтической промышленности при изготовлении лекарственных препаратов (например, фосфакол, АТФ – и др.), зубных паст и порошков.
Л. В. Кубасова.
Из эфиров кислот наиболее известны одно-, двух- и трехзамещенные ортофосфаты, соответственно ROP ()()2, (RO)2 () и ()3 (где R – алкил, арил или гетероциклический остаток). Получаются при взаимодействии 3 со спиртами:
3 + 3ROH ® (RO)3
3 + 2ROH ® (RO)2 () 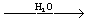 (RO)2 () (RO)2 ()
и др. способами.
Применяются как пестициды, присадки к маслам, экстрагенты и т.д. Некоторые органические Ф (нуклеиновые кислоты, аденозинфосфорные кислоты) выполняют важные функции в живых организмах.
Э. Е. Нифантьев.
Лит.: Продан Е. А., Продан Л. И., Ермоленко Н. Ф, Триполифосфаты и их применение, Минск, 1969; см. также лит. при ст. Фосфор.
|
Для поиска, наберите искомое слово (или его часть) в поле поиска
|

|
 |
 |
 |

|

|
Новости 30.01.2026 14:23:15
|

|

|
 |
|

|
 |
 |
 |
|