
|

|
Большая Советская Энциклопедия (цитаты)
|

|

|
 |
Скандий | Скандий (далее С) (лат. Scandium), , элемент группы периодической системы номер 21, масса 44,9559; легкий металл с характерным желтым отливом, который появляется при контакте металла с воздухом. Известен один природный стабильный изотоп 45. Из 10 искусственных радиоактивных изотопов важнейший 46 с периодом полураспада 84 сут. С был предсказан Д. И. Менделеевым в 1870 и выделен в 1879 Л. Ф. Нильсоном из минералов и эвксенита, найденных в Скандинавии (лат. Scandia), отсюда и название элемента.
Распространение в природе. Среднее содержание С в земной коре (кларк) 2,2×10-3% по массе. В горных породах содержание С различно: в ультраосновных 5×10-4, в основных 2,4×10-3, в средних 2,5×10-4, в гранитах и сиенитах 3.10-4; в осадочных породах (1—1,3).10-4. С концентрируется в земной коре в результате магматических, гидротермальных и гипергенных (поверхностных) процессов. Известно два собственных минерала С — тортвейтит и стерреттит; они встречаются чрезвычайно редко. В целом С — типичный рассеянный элемент, слабый мигрант (см. также Рассеянных элементов руды). Содержание С в морской воде 4×10-5 г/л.
Физические и свойства. С существует в двух модификациях: a и b; при обычной температуре устойчива a-модификация с гексагональной решеткой (а = 3,3080 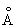 и с = 5,2653 и с = 5,2653 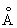 ), выше 1350 °С — b-модификация с кубической объемноцентрированной решеткой. Плотность С в а-форме при 25 °С 3,020 г/см3, радиус 1,64 ), выше 1350 °С — b-модификация с кубической объемноцентрированной решеткой. Плотность С в а-форме при 25 °С 3,020 г/см3, радиус 1,64 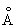 , ионный радиус 0,75 , ионный радиус 0,75 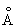 , tпл 1539 ± 5 °С, tkип 2700 °, выше 1600 °С летуч. При 25 °С удельная теплоемкость 25,158 кдж/(кг. К) (6,01 ккал/ (г×°С)), удельное электрическое сопротивление (54—70,7).10-6 ом×см, С слабый парамагнетик, его восприимчивость 236-10-6 (20 °С). — первый переходный элемент с одним 3d электроном; конфигурация внешних электронов 3d14s2. , tпл 1539 ± 5 °С, tkип 2700 °, выше 1600 °С летуч. При 25 °С удельная теплоемкость 25,158 кдж/(кг. К) (6,01 ккал/ (г×°С)), удельное электрическое сопротивление (54—70,7).10-6 ом×см, С слабый парамагнетик, его восприимчивость 236-10-6 (20 °С). — первый переходный элемент с одним 3d электроном; конфигурация внешних электронов 3d14s2.
С— мягкий металл, в чистом состоянии легко поддается обработке — ковке, прокатке, штамповке.
По хим. поведению сходен с др. переходными элементами в степени окисления +3 (например, 3+, 3+, Мп3+), элементами подгруппы , , а также элементами иттриевой подгруппы, вместе с которыми его иногда относят к редкоземельным элементам. На воздухе покрывается защитной окисной пленкой толщиной до 600Ǻ, заметное окисление начинается при 250 °С При взаимодействии с (450 °С) образуется гидрид 2, с (600—800 °С) — нитрид , с галогенами (400—600 °С) — соединения типа 3; С реагирует также с бором и при температуре выше 1000 °С Металл легко растворяется в соляной, и серной кислотах (с понижением концентрации кислоты скорость растворения С резко падает и с 0,001 н. растворами он не реагирует). Соли соляной, серной, роданистоводородной и уксусной кислот хорошо растворяются в воде, а соли щавелевой и плавиковой кислот мало растворимы; некоторой летучестью обладают ацетилацетонат и его На С практически не действуют разбавленные растворы (10%) и смесь концентрированных 3 и (1: 1). В воде соединения С заметно гидролизуются с образованием основных солей. Ионы 3+ склонны к полимеризации, образованию комплексных ионов различного типа, состав которых зависит от природы аниона и pH среды, например (3)-2, (4)3-3. Основные соли в растворе легко переходят в аморфную гидроокись.
Получение и применение. С преимущественно в виде окислов извлекают попутно при гидро- и пирометаллургической переработке руд и бокситов. Окислы или при повышенной температуре, а затем компактный металлический С (выход ~ 99,5°о) получают термическим восстановлением его или металлическим с последующей дистилляцией (возгонкой) в высоком вакууме 133,3×10-6 н/м2 (10-6 мм рт. cm.) при 1600—1700 °С
Масштабы применения С весьма ограничены. Окись С идет на изготовление ферритов для элементов памяти быстродействующих вычислительных машин. Радиоактивный 46 используется в нейтронно-активационном анализе и в медицине. Сплавы С, обладающие небольшой плотностью и высокой температурой плавления, перспективны как конструкционные материалы в ракето- и самолетостроении, а ряд соединений С может найти применение при изготовлении люминофоров, оксидных катодов, в стекольном и керамических производствах, в промышленности (в качестве катализаторов) и в других областях.
Лит.: Борисенко Л. Ф., С, М, 1961; Фаворская Л. В., технология скандия, А.-А., 1969; Коган Б. И., Названова В. А., С, М., 1961; Справочник но редким металлам, пер. с англ., М., 1965; Vickery R. С, The chemistry of yttrium and scandium, Oxf., 1960.
Л. Н. Комиссарова |
Для поиска, наберите искомое слово (или его часть) в поле поиска
|

|
 |
 |
 |

|

|
Новости 13.02.2026 06:12:48
|

|

|
 |
|

|
 |
 |
 |
|