
|

|
Большая Советская Энциклопедия (цитаты)
|

|

|
 |
Атомные радиусы | радиусы (далее А) характеристики позволяющие приблизительно оценивать межатомные расстояния в веществах. Согласно квантовой механике, не имеет определенных границ, но вероятность найти электрон на данном расстоянии от ядра начиная с некоторого расстояния, весьма быстро убывает. Поэтому можно приближенно приписать некоторый размер. Для всех этот размер порядка 10-8 см, т. е. 1 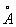 или 0,1 нм. Опытные данные показывают, что, суммируя для А и В значения величин, называются А, во многих случаях удается получить значение межатомного расстояния AB в соединениях и близкое к истинному. Это свойство межатомных расстояний, называется аддитивностью, оправдывает применение А Последние подразделяются на металлические и ковалентные. или 0,1 нм. Опытные данные показывают, что, суммируя для А и В значения величин, называются А, во многих случаях удается получить значение межатомного расстояния AB в соединениях и близкое к истинному. Это свойство межатомных расстояний, называется аддитивностью, оправдывает применение А Последние подразделяются на металлические и ковалентные.
За металлический радиус принимается половина кратчайшего межатомного расстояния в структуре элемента-металла. Металлический радиус зависит от числа ближайших соседей в структуре (координационного числа К). Если принять А при К = 12 (это значение К чаще всего встречается в металлах) за 100%, то А при К = 8,6 и 4 составят 98,96 и 88% соответственно. А металлов применяют для предсказания возможности образования и анализа строения сплавов и интерметаллических соединений. Так, близость А — необходимое, хотя и недостаточное условие взаимной растворимости металлов по типу замещения: (А 1,60 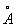 ) в широких пределах образует твердые растворы с литием (1,55 ) в широких пределах образует твердые растворы с литием (1,55 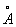 ) и практически не образует их с и (1,89 ) и практически не образует их с и (1,89 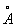 и 2,36 и 2,36 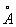 ). Аддитивность А позволяет ориентировочно предсказывать параметры решеток интерметаллов (например, для тетрагональной структуры b-2, расчет дает а = 3,06 ). Аддитивность А позволяет ориентировочно предсказывать параметры решеток интерметаллов (например, для тетрагональной структуры b-2, расчет дает а = 3,06 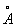 , с = 8,60 , с = 8,60 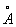 , соответствующие экспериментальные значения 3,00 , соответствующие экспериментальные значения 3,00 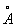 и 8,63 и 8,63 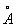 ). ).
КовалентныеА представляют собой половину длины ординарной связи Х — X, где Х — элемент-неметалл. Так, например, в случае галогенов А— это половина межатомного расстояния в молекулах X2, для серы и — в молекулах X8, для — это половина длины связи в структуре алмаза или в молекулах предельных углеводородов. Повышение кратности связи (например, в молекулах бензола, этилена, ацетилена) приводит к уменьшению ее длины, что иногда учитывают введением соответствующей поправки. Приблизительно выполняющаяся аддитивность ковалентных радиусов позволяет вычислить их значения и для металлов (из длин ковалентных связей Me — X, где Me — металл). В некоторых исследованиях, сравнивая экспериментально найденные расстояния Me — Х с суммами ковалентных радиусов и ионных радиусов, судят о степени ионности связи. Однако межатомные расстояния Х—Х и Me — Х заметно зависят от валентного состояния Последнее уменьшает универсальность ковалентных радиусов и ограничивает возможность их применения. О связи А элементов с их положением в периодической системе см. Периодическая система элементов Д. И.
Лит.: Бокий Г. Б., 2 изд., М., 1960; Жданов Г. С., Физика твердого тела, М., 1962; Китайгородский А. И., Органическая М., 1955; Bastiansen О., Тraetteberg M., The nature of bonds between carbon atoms, "Tetrahedron", 1962, v. 17, №3.
П. М. Зоркий. |
Для поиска, наберите искомое слово (или его часть) в поле поиска
|

|
 |
 |
 |

|

|
Новости 03.02.2026 14:34:17
|

|

|
 |
|

|
 |
 |
 |
|