
|

|
Большая Советская Энциклопедия (цитаты)
|

|

|
 |
Германий | (далее Г)(лат. Germanium), , элемент группы периодической системы порядковый номер 32, масса 72,59; твердое вещество серо-белого цвета с металлическим блеском. Природный Г представляет собой смесь пяти стабильных изотопов с массовыми числами 70, 72, 73, 74 и 76. Существование и свойства Г предсказал в 1871 Д. И. и назвал этот неизвестный еще элемент "экасилицием" из-за близости свойств его с В 1886 немецкий химик К. Винклер обнаружил в минерале аргиродите новый элемент, который назвал Г в честь своей страны; Г оказался вполне тождествен "экасилицию". До 2-й половины 20 в. практическое применение Г оставалось весьма ограниченным. Промышленное производство Г возникло в связи с развитием полупроводниковой электроники.
Общее содержание Г в земной коре 7.10—4% по массе, т. е. больше, чем, например, Однако собственные минералы Г встречаются исключительно редко. Почти все они представляют собой сульфосоли: 2(, , , )2 (, )4, аргиродит 86, конфильдит 8(, ) 6 и др. Основная масса Г рассеяна в земной коре в большом числе горных пород и минералов: в сульфидных рудах цветных металлов, в рудах, в некоторых окисных минералах ( магнетите, рутиле и др.), в гранитах, диабазах и базальтах. Кроме того, Г присутствует почти во всех силикатах, в некоторых месторождениях каменного угля и нефти.
Физические и свойства. Г в кубической структуре типа алмаза, параметр элементарной ячейки а = 5, 6575 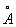 . Плотность твердого Г 5,327 г/см3 (25°С); жидкого 5,557 (1000°С); tпл 937,5°С; tkип около 2700°С; коэффициент теплопроводности ~60 вт/(м (К), или 0,14 кал/(см (сек (град) при 25°С. Даже весьма чистый Г хрупок при обычной температуре, но выше 550°С поддается пластической деформации. Твердость Г по минералогической шкале 6—6,5; коэффициент сжимаемости (в интервале давлений 0—120 Гн/м2 или 0—12000 кгс/мм2) 1,4·10—7 м2/мн (1,4·10—6 см2/кгс); поверхностное натяжение 0,6 н/м (600 дин/см). Г — типичный полупроводник с шириной запрещенной зоны 1,104·10—19, или 0,69 эв (25°С); удельное электросопротивление Г высокой чистоты 0,60 ом (м (60 ом (см) при 25°С; подвижность электронов 3900 и подвижность дырок 1900 см2/в. сек (25°С) (при содержании примесей менее 10—8%). Прозрачен для инфракрасных лучей с длиной волны больше 2 мкм. . Плотность твердого Г 5,327 г/см3 (25°С); жидкого 5,557 (1000°С); tпл 937,5°С; tkип около 2700°С; коэффициент теплопроводности ~60 вт/(м (К), или 0,14 кал/(см (сек (град) при 25°С. Даже весьма чистый Г хрупок при обычной температуре, но выше 550°С поддается пластической деформации. Твердость Г по минералогической шкале 6—6,5; коэффициент сжимаемости (в интервале давлений 0—120 Гн/м2 или 0—12000 кгс/мм2) 1,4·10—7 м2/мн (1,4·10—6 см2/кгс); поверхностное натяжение 0,6 н/м (600 дин/см). Г — типичный полупроводник с шириной запрещенной зоны 1,104·10—19, или 0,69 эв (25°С); удельное электросопротивление Г высокой чистоты 0,60 ом (м (60 ом (см) при 25°С; подвижность электронов 3900 и подвижность дырок 1900 см2/в. сек (25°С) (при содержании примесей менее 10—8%). Прозрачен для инфракрасных лучей с длиной волны больше 2 мкм.
В соединениях Г обычно проявляет валентности 2 и 4, причем более стабильны соединения 4-валентного Г При комнатной температуре Г устойчив к действию воздуха, воды, растворам щелочей и разбавленных соляной и серной кислот, но легко растворяется в царской водке и в щелочном растворе перекиси кислотой медленно окисляется. При нагревании на воздухе до 500—700°С Г окисляется до окиси и двуокиси 2. Двуокись Г — белый порошок с tпл 1116°С; растворимость в воде 4,3 г/л (20°С). По свойствам амфотерна, растворяется в щелочах и с трудом в минеральных кислотах. Получается прокаливанием гидратного осадка (2. n2), выделяемого при гидролизе тетрахлорида 4. Сплавлением 2 с др. окислами могут быть получены производные кислоты — германаты металлов (23, 2 О3 и др.) — твердые вещества с высокими температурами плавления.
При взаимодействии Г с галогенами образуются соответствующие тетрагалогениды. Наиболее легко реакция протекает с и (уже при комнатной температуре), затем с (слабое нагревание) и с иодом (при 700—800°С в присутствии ). Одно из наиболее важных соединений Г тетрахлорид 4 — бесцветная жидкость; tпл —49,5°С; tkип 83,1°С; плотность 1,84 г/см3 (20°С). Водой сильно гидролизуется с выделением осадка гидратированной двуокиси. Получается металлического Г или взаимодействием 2 с концентрированной НС1. Известны также дигалогениды Г общей формулы GeX2, монохлорид , гексахлордигерман 26 и оксихлориды Г (например, 2).
Сера энергично взаимодействует с Г при 900—1000°С с образованием дисульфида 2 — белого твердого вещества, tпл 825°С. Описаны также моносульфид и аналогичные соединения Г с и которые являются полупроводниками. незначительно реагирует с Г при 1000—1100°С с образованием гермина () x — малоустойчивого и легко летучего соединения. Взаимодействием с разбавленной соляной кислотой могут быть получены германоводороды ряда n2n+2 вплоть до 920. Известен также гермилен состава 2. С Г непосредственно не реагирует, однако существует нитрид 34, получающийся при действии аммиака на Г при 700—800°С. С Г не взаимодействует. Г образует соединения со многими металлами —
Известны многочисленные комплексные соединения Г которые приобретают все большее значение как в аналитической химии Г так и в процессах его получения. Г образует комплексные соединения с органическими гидроксилсодержащими молекулами (многоатомными спиртами, многоосновными кислотами и др.). Получены гетерополикислоты Г Так же, как и для др. элементов группы, для Г характерно образование металлорганических соединений, примером которых служит тетраэтилгерман (25)4 3.
Получение и применение. В промышленной практике Г получают преимущественно из побочных продуктов переработки руд цветных металлов ( обманки, полиметаллических концентратов), содержащих 0,001—0,1% Г В качестве сырья используют также золы от сжигания угля, пыль газогенераторов и отходы коксохимических заводов. Первоначально из перечисленных источников различными способами, зависящими от состава сырья, получают концентрат (2—10% Г Извлечение Г из концентрата обычно включает следующие стадии: 1) концентрата соляной кислотой, смесью ее с в водной среде или др. агентами с получением технического 4. Для очистки 4 применяют ректификацию и экстракцию примесей концентрированной . 2) Гидролиз 4 и прокаливание продуктов гидролиза до получения 2. 3) Восстановление или аммиаком до металла. Для выделения очень чистого Г используемого в полупроводниковых приборах, проводится зонная плавка металла. Необходимый для полупроводниковой промышленности монокристаллический Г получают обычно зонной плавкой или методом Чохральского (см. Монокристаллы).
Г — один из наиболее ценных материалов в современной полупроводниковой технике (см. Полупроводниковые материалы). Он используется для изготовления диодов, триодов, и силовых выпрямителей. Монокристаллический Г применяется также в дозиметрических приборах и приборах, измеряющих напряженность постоянных и переменных полей. Важной областью применения Г является инфракрасная техника, в частности производство инфракрасного излучения, работающих в области 8—14 мк. Перспективны для практического использования многие сплавы, в состав которых входят Г стекла на основе 2 и др. соединения Г (см. также Германиды).
Лит.: Тананаев И. В., Шпирт М. Я., М., 1967; Угай Я. А., Введение в химию полупроводников, М., 1965; Давыдов В. И., М., 1964; Зеликман А. Н., Крейн О. Е., Самсонов Г В., Металлургия редких металлов, 2 изд., М., 1964; Самсонов Г В., Бондарев В. Н., М., 1968.
Б. А. Поповкин. |
Для поиска, наберите искомое слово (или его часть) в поле поиска
|

|
 |
 |
 |

|

|
Новости 30.01.2026 00:33:19
|

|

|
 |
|

|
 |
 |
 |
|