
|

|
Большая Советская Энциклопедия (цитаты)
|

|

|
 |
Водородный показатель | показатель (далее В), pH, отрицательный десятичный логарифм концентрации (точнее, активности) ионов (в г-ион/л) в данном растворе:
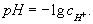
В служит количественной характеристикой кислотности растворов, которая оказывает существенное влияние на направление и скорость многих и биохимических процессов. При обычных температурах (точнее, при 22 °С) pH = 7 для нейтральных, pH < 7 для кислых и pH > 7 для щелочных растворов. Точное измерение и регулирование pH необходимо как при лабораторных и биохимических исследованиях, так и в многочисленных промышленных технологических процессах, а также при оценке свойств почвы и проведении мероприятий по повышению ее плодородия.
Вода диссоциирует на ионы по уравнению
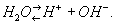
По действующих масс закону:
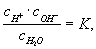
где с — молярные концентрации, а К — постоянная при данной температуре величина (1,8·10-16 г-ион/л при 22 °С). В 1 л воды содержится
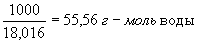
(количество диссоциировавших молекул настолько мало, что его можно не учитывать). Поэтому
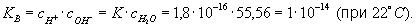
Константу КВ называют ионным произведением воды. Поскольку в чистой воде (и в любой нейтральной среде)
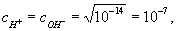
то
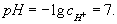
При добавлении к воде кислот c+ возрастает, а pH соответственно уменьшается. Так, для 0,01 молярного (М) раствора концентрация c+ = 10-2 и pH = —lgc+ = 2. Наоборот, при добавлении щелочей возрастает c-; тогда
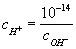
уменьшается и соответственно возрастает pH.
Например, в 0,01 М растворе c- = 10-2. Это значит, что
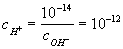
и pH = 12.
Для точных определений pH используют преимущественно методы потенциометрии (см. Электрохимические методы анализа). При определениях, не требующих высокой точности, pH измеряют б. ч. с помощью набора индикаторов, меняющих свою окраску каждый при определенном pH. Шкала pH обычно используется для растворов, имеющих концентрации ионов от 1 г-ион/л и меньше.
Нейтральным водным растворам отвечает pH = 7 лишь при комнатных температурах. При повышении температуры диссоциация воды усиливается, возрастает, и при 100 °С чистая вода имеет pH " 6. При температурах ниже 22 °С в чистой воде pH > 7. При этом во всех случаях в нейтральной среде c+ = c-.
Лит.: Киреев В. А., Краткий курс физической химии, 4 изд., М., 1969.
В. Л. Василевский. |
Для поиска, наберите искомое слово (или его часть) в поле поиска
|

|
 |
 |
 |

|

|
Новости 30.01.2026 13:16:15
|

|

|
 |
|

|
 |
 |
 |
|